Sobre los virus, el nuevo coronavirus covid-19 (ncov-19) y su riesgo pandémico
Ricardo Andrés Roa-Castellanos
Ricardo Andrés Roa-Castellanos
La palabra virus procede etimológicamente del latín virus y este del griego: ἰός que significa “toxina” o “veneno”.
Esta denominación fue causada por cuanto los primeros virus detectados en laboratorio causaban enfermedades en las especies estudiadas (P.ej. El Virus del Mosaico del Tabaco, fue descubierto en 1892 por el trabajo de filtración y transmisión ejecutado por D. Ivanovski al usar el filtro de Chamberland para esta enfermedad vegetal; no obstante, previamente, en 1888, el retrovirus causante de la Anemia Infecciosa Equina, enfermedad identificada en caballos de Francia, en 1843, fue filtrado de forma pionera por Veterinarios, que luego, para 1898 filtrarían el virus de la Fiebre Aftosa[1].
Sólo hasta 1900, Walter Reed comprobaría la teoría del médico Carlos Finlay (1881), según la cual una partícula inductora de enfermedad -vehiculizada por mosquitos- sería la causante de la Fiebre Amarilla, que aquejaba a los humanos en inmediaciones al Mar Caribe (partícula que a la postre resultaría ser un arbovirus aislado en 1932 por Max Theiler).
Desde la medicina antigua era claro que había aires, lugares o sitios (Topoi), suelos, cuerpos de agua específicos y humedades, que podían relacionarse con la iniciación de las enfermedades.
Ello provocaría la pre-figurativa Teoría Miasmática de la Enfermedad en el Siglo XVII por parte de Thomas Sydenham (1624-1689) y Giovanni María Lancisi (1654-1720). Líquidos, ambientes o aires cargados de emanaciones patológicas (miasmas) eran la causa de que algunas enfermedades se presentasen.

CORRELATOS Y CONVERGENCIAS: LO NUEVO Y LO VIEJO
Al pensarlo integralmente, la visión miasmática, cuya esencia es hoy es retomada por campos de vanguardia tales como la EcoSalud, Una Salud, la Biogeomedicina o la Medicina Geológica, significaba para el contexto ambiental una compatible convergencia de disciplinas, inter- y multidisciplinas actuales, como terminarían siendo la Microbiología clínica, la Epidemiología, la Toxicología y la Salud Ambiental.
Los miasmas evocan la correspondencia comprobada hoy con fenómenos como la infección e infestación provocada por priones, virus, bacterias, hongos o parásitos endémicos ligados a un componente ambiental de peso en la triada epidemiológica[2]. Para la virología (ciencia que estudia los virus), estos microorganismos, complementariamente, han sido longevos compañeros que han acompañado a las variadas formas de vida en la historia de la tierra, desde antes que el hombre apareciese.
De hecho, el tipo de placenta que poseemos los homínidos se la debemos a los virus.
Sobre ello conviene acotar: 1) Que los homínidos son una familia de primates hominoideos, que incluyen 4 géneros y 7 especies vivientes, entre las cuales se halla el ser humano y sus parientes evolutivos cercanos, orangutanes, gorilas, chimpancés y bonobos[3]. 2) También, el tipo de virus que indujo el tipo de placenta hemocorial discoidal[4] que compartimos los homínidos con los prolíficos roedores es debida a los llamados retrovirus endógenos (ERVs, por sus siglas en inglés) que se incluyeron con el transcurrir del tiempo dentro de nuestra información genética.
Con base en lo anterior, las placentas hemocoriales se caracterizan no sólo por su origen promovido por una acción proviral, sino por cuanto el embrión quedó en contacto más directo con el sistema circulatorio de la madre por medio de estructuras conocidas como sincitiotrofoblastos, donde vellosidades laberínticas actúan como filtro conector entre el nasciturus y su madre que, sin embargo, implican una más eficiente estructura de bioseguridad para el conceptus[5].
En el caso de los retrovirus, que dependen de un mecanismo de caballo de Troya para vivir y replicarse, la barrera laberíntica retiene células infectadas y en el caso de embarazo humano y preñez animal, el retrovirus de cada especie, no infecta al feto dado el efectivo filtro hemocorial. El contagio se realiza vía lactancia o por escoriaciones, soluciones de continuidad, o heridas sufridas durante el parto.
Valga decir que los retrovirus contienen proteínas conocidas como sincitinas - codificadas por el gen viral Env - que les permiten fusionar sus membranas con las de su hospedero (Igualmente, otro tipo de retrovirus, el HIV, emplea la membrana celular del huésped como un Casco de Hades o Capa de Invisibilidad Ateniense, de Hermes o de Perseo, para pasar desapercibido, sin reconocimiento inmunológico en su etapa de colonización dentro del hospedero hasta llegar a los ganglios linfáticos y replicarse más eficientemente).
Según rastreos científicos, por lo visto, hace cerca de 25 millones de años un retrovirus infectó las células reproductivas germinales -óvulos o espermatozoides- de un proto-simio. La capacidad de cambio geno- y fenotípico por parte de los transposones derivados de fragmentos de los provirus (retrovirus insertados en el ADN del huesped) han implicado incluso procesos de diversificación de especies[6].
Con el tiempo, el Provirus que se incluye en el ADN del huésped, tras la Transcripción de ARN en ADN por la famosa transcriptasa reversa -cuyo descubrimiento tumbó el Dogma de Biología Molecular- lo que garantiza su replicabilidad. El ERV fue mutando a la par que colonizaba, asintomáticamente, los huéspedes en grado poblacional. Los simios reutilizaron la sincitina en la placenta para disolver las paredes arteriales de la madre, generando el denominado sincitiotrofoblasto.
Sea este, entonces, un ejemplo de CO-EVOLUCIÓN poblacional o Evolución Convergente, ya que también roedores tales como los ratones, adquirieron independientemente sincitinas que se expresan en la placenta. Similarmente, parece que los virus no son sólo responsables de generar la placenta hemocorial, hay datos que parecen indicar que la habilidad de los embriones mamíferos de reprimir el sistema inmunológico de la madre también es de origen viral. Pero como es sabido, las madres no son seres indefensos, y la evolución les dio un mecanismo de defensa, la decidualización secundaria.
COMPARACIÓN COMO MÉTODO DE COMPRENSIÓN
El padre de la Sociología clásica, Emile Durkheim (1979), en Las Reglas del Método Sociológico, explica que la comparación es una manera que facilita la comprensión funcional.
Extrapolando esta característica sistémica, desde las descripciones previas, notemos algunos aspectos con la familia viral Coronaviridae (que comprende los géneros Alphacoronavirus, Betacoronavirus, Gammacoronavirus, y más recientementemente descubiertos -en 2009- los Deltacoronavirus) la cual a diferencia de los crónicos Retrovirus, en que causan enfermedades de curso agudo o subagudo (relativamente rápidas en su desarrollo patogénico), y en que se asemejan en cuanto a que algunas de sus cepas cuentan con potencial zoonótico (capacidad de infectar al hombre) al romper las barreras de contagio entre especies. El SIDA provino de el Virus de Inmunodeficiencia de los Simios (SIV).
Sobre este particular hay que decir que varias de las infecciones más comunes de cada especie, suelen ser específicas para cada una. A manera de ilustración, un gato no suele sufrir de sarampión, que es una infección de humanos, al igual que un ser humano no padece de la enfermedad viral aviar de New Castle, que puede tener un muy rápido desarrollo de su patogenia y capacidad de transmisión (velogénico), así como puede resultar bastante contagioso y fatal (virulento).
SALTANDO LA BARRERA ESPECÍFICA DE ESPECIE
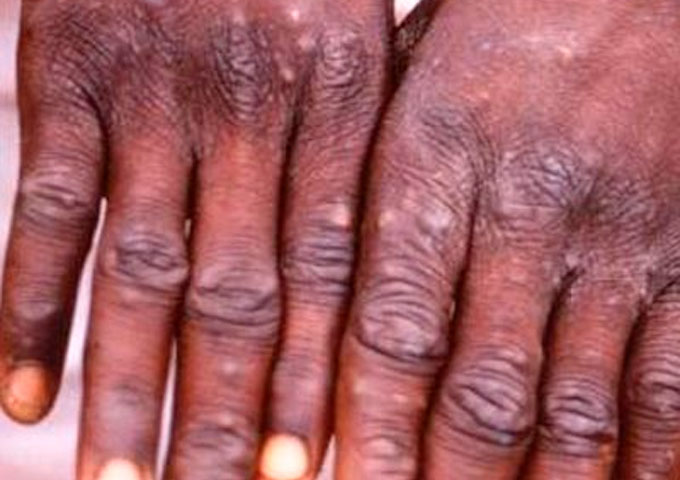
Sin embargo, algunos patógenos son capaces de adaptarse o mutar y saltar dichas barreras. Por ejemplo, la Viruela del Mono (Monkeypox) solía ser una infección limitada a primates, pero en el siglo XX (1970), y más recientemente, desde 2018, ha provocado brotes en humanos que irrumpieron en nichos ecológicos, o roedores que, al hacer lo mismo, vulneraron lugares que al estar intactos mantenían circunscrita (endémica) la enfermedad, alejada del ser humano[7].
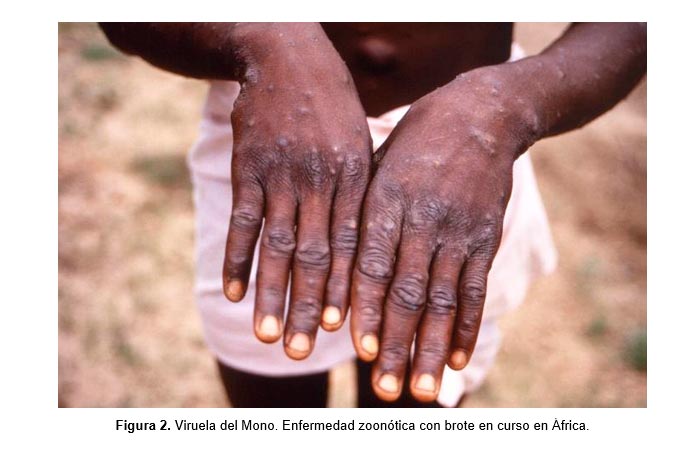
Para 2018, los casos de esta zoonosis de la primatología en África, contabilizaron 113 casos confirmados, con 7 muertes y 2 casos importados al Reino Unido, en 6 países[8]. Las cifras en 2019 ya escalaron. Los humanos infectados llegaron a ser 5.000 y las muertes superaron la centena para esta zoonosis. En lo que va corrido de este año (2020), enero reportaba >222 casos de viruela del mono en humanos tan solo dentro de la República Democrática del Congo[9].
Así las cosas, la especie puede ser una barrera para el contagio de los Coronavirus para algunos de sus tipos. Pero, en 2003, el virus SARS (Síndrome Respiratorio Agudo Severo), otro tipo de coronavirus (CoV) que saltó las barreras de especie, resultó infectando Humanos y Cerdos al convertirse en una zoonosis emergente de alto impacto.
Para 2005, aún se identificaban cerdos positivos al SARS-CoV cuya única fuente probable eran los alimentos de los animales, es decir, una transmisión por vector mecánico con la capacidad de infectar pese a las otras estrictas maniobras de bioseguridad[10]. Por eso el tema de los alimentos, e implementos o productos contaminados abren una compuerta de acceso a esta clase de virus que debe ser tenida a raya. Los humanos pudieron en este caso llevar el virus a los animales dado el consumo de animales silvestres como murciélagos en China.
El saldo del brote SARS implicó, finalmente, la muerte de aproximadamente 800 personas. En comparación, como se nota en la Figura 1, COVID-19 sobre la mitad de febrero y habiendo empezado en diciembre de 2019, lleva más de 2.000 casos mortales y >75.000 infectados al escribir este documento[11]. La virulencia de COVID-19 es mucho mayor que la de SARS al tener la primera una tasa de fatalidad de 2.3%[12] a 2,7%11. La tasa de fatalidad para la Viruela de los Monos, en comparación, llegó a ser de 10% aunque el contagio entre humanos ha sido menor que en COVID-19[13].
Luego, en 2018, también en Asia oriental, el coronavirus del síndrome de diarrea aguda (SADS-CoV), un nuevo Coronavirus HKU2, relacionado con murciélagos, resultó ser el agente etiológico responsable de un brote a gran escala de enfermedad mortal en cerdos en China que causó la muerte de 24.693 lechones en cuatro granjas. El brote se inició en la provincia de Guangdong, en las proximidades del origen de la pandemia de SARS. Además, se identificaron CoV relacionados con SADS con un 96-98% de identidad secuencial en 9,8% (58 de 591) de los hisopos anales recogidos de murciélagos en la provincia de Guangdong durante los años 2013 a 2016, de forma predominante en los murciélagos Rhinolophus spp. conocidos reservorios de CoV relacionados con el SARS[14].
Al haber señalado que la Medicina Veterinaria ha adelantado en lo que respecta a la virología de la Medicina Humana, contrastemos las lecciones aprendidas en ambos campos. La aseveración anterior se comprueba incluso en la historia del SIDA donde los investigadores Gallo y Montaigner no pudieron encontrar el método replicativo del HIV hasta que Arsene Burny, virólogo veterinario belga, les dio el protocolo para cultivar retrovirus bovinos en células de murciélago. Pero el premio Nobel de medicina se lo disputaron entre los dos primeros… En fin. Continuemos:
Los Coronavirus de los animales domésticos (caninos, porcinos, vacunos), para los cuales ya se cuenta con vacunas específicas en el campo de la veterinaria, se destacan por ser patógenos presentes con mayor frecuencia en los individuos más vulnerables ontoinmunogenéticamente, es decir, los neonatos, las formas infantiles o jóvenes y los adultos de tercera edad, en adelante. Esta tipología comparativa de los seres muy jóvenes que dependen de la llamada Inmunidad Pasiva NATURAL, con gran eficiencia son protegidos de los coronavirus circundantes por el calostro y la lactancia materna.
Si bien estas formas infantiles de la Medicina de animales, no necesariamente están inmunodeprimidos, su estado es de vulnerabilidad defensiva, si hay precariedad o carencia de tal inmunidad transferida por la madre. En el ejemplo bovino, esta resistencia viral está mediada por el anticuerpo IgG1 anti-BCoV maternal[15]. Si bajan esos anticuerpos hay desarrollo de la enfermedad.
En medicina humana con el problemático Nuevo Coronavirus-19 de la epidemia china, ya ha sido reportado el contagio de dos recién nacidos con madres positivas a la infección en el momento del parto[16]. Repasando, la placenta es la puerta de seguridad del santuario vital que implica el útero para el feto (desde que no haya activistas o jueces injustos alrededor).
Por tanto, es probable que en el caso de los neonatos contagiados, ello hubiese ocurrido por contacto directo entre la madre y su bebé más que por una transmisión transplacentaria. En concordancia, un temprano estudio publicado en The Lancet concluía preliminarmente la misma hipótesis[17]. Así, si la infección está activa debería separarse la madre del niño como se hace en las retrovirosis (HTLV, HIV). Una vez recuperada la salud materna en el caso de los coronavirus, donde puede haber recuperación, los anticuerpos transferidos con la lactancia harán bien y protegerán al crio.
Los casos de personas recuperadas invocan, también, el uso de su suero para transferir Inmunidad Pasiva Artificial. El 2019-nCoV ingresa a las células a través de la misma ruta que los coronavirus SARS: lo hace a través del receptor de células ACE2[18]. Además, demuestra que los anticuerpos aislados de pacientes infectados con 2019-nCoV tienen el potencial de neutralizar el virus. Anticuerpos equinos previamente identificados contra el SARS-CoV también neutraliza el virus a una dilución de suero baja, pero si los anticuerpos anti-SARS-CoV reaccionan de forma cruzada con 2019-nCoV necesita confirmarse usando suero de humanos convalecientes de la infección del SARS. El betacoronavirus del SARS tiene una homología del 99,5% con el nuevo CoV que a su vez es >96% similar al virus característico de los murciélagos[19].
LECCIONES APRENDIDAS
En suma, los virus son compañeros de viaje que obligan a la evolución. En el camino muchos pierden el examen. Sin embargo, representan oportunidades de evolución en muchos otros sentidos.
Para la Medicina Veterinaria, los desarrollos en los relativo a manejo de CoVs han estado más adelantados. Esto sugiere que el modelo One Health sea la mejor herramienta de abordaje transdisciplinario para bien de la Salud Humana, Animal y Ambiental.
La Coronavirosis canina, por ejemplo, afecta a cachorros. Puede confundirse por su gravedad en estos con la famosa parvovirosis. Pero su manejo profiláctico con vacunas y medidas de bioseguridad estrictas permite superar brotes. De modo similar ocurre con los terneros con los cuales hemos aprendido que el calostro y leche materna con anticuerpos brindan una contención inmunitaria pasiva.
Para el caso de las Coronavirosis en cerdos, sí que hay experiencia de sobra y rutinaria, pero, las extrapolaciones son aquí benéficas en lo relativo a manejos de poblaciones con individuos en cercana proximidad que asemejan a los modos de vida humanos-urbanos.
Los Coronavirus en cerdos son el origen de cinco patologías cuya detección, por orden cronológico, serían:
De dichos coronavirus porcinos, 3 están asociados a trastornos digestivos (GET, DEP y PDCoV). El Coronavirus respiratorio porcino (CRPv) está asociado a problemas respiratorios y el virus EHV da lugar a dos síndromes diferentes, la enfermedad del vómito más desmedro y la encefalomielitis.
Las grabaciones de pacientes humanos con COVID-19, en algunos casos, sugieren compromisos neurológicos. En concordancia, es claro que el tropismo de los Coronavirus se dirige a los aparatos respiratorio, digestivo y nervioso central.
Esto debe orientarnos para medidas en Bioseguridad, como la estricta higienización de manos que puede disminuir el riesgo de transmisión en casi un 40%[20]; además del manejo de distancias, esterilizaciones, evitaciones en el manejo descuidado de fómites, etc.; el rutinario y frecuente baño de manos, y uso de gafas para prevenir el contacto de aerosoles o secreciones con la conjuntiva que pueda desatar la infección, nos pide, entonces, tener especial cuidado con secreciones respiratorias, digestivas, oculares y el denominado contacto directo.

Para tener un patrón imitativo, en las muy bioseguras granjas porcícolas, las principales medidas de control de coronavirus están basadas en la prevención sobre el manejo espacio-temporal, a saber:
Mi maestro de Salud Pública, Ricardo León Vega Aragón, MVZ, Ph.D. (QEPD), siempre temió lo que este evento ha representado. Una enfermedad de animales que dadas las excéntricas costumbres alimenticias asiáticas, por vía de la disrupción de nichos ecológicos, terminase por contagiar seres humanos, pero teniendo dicho patógeno la capacidad de fácil contagio entre humanos. Con la dureza disciplinar que caracteriza el buen obrar de los salubristas, no se puede incurrir en falsos humanitarismos trayendo personal potencialmente infectado. Ya que la infección inaparente o asintomática y que los periodos de incubación son relativamente largos (hasta 24 días[23]), es necesario emular la conducta de los rusos al restringir el acceso internacional a personal proveniente de estas áreas ahora endémicas de la infección hasta que el evento pase[24]. La enfermedad puede transmitirse a una distancia de 2 metros adquiriéndose a través de los ojos[25].
[1] Fernández López, M. A., & Picado Ramírez, S. R. (2007). Seroprevalencia de anemia infecciosa equina (AIE) en caballos de tracción en la ciudad de León, Nicaragua, en el año 2006 (Doctoral dissertation).
[2] Osorio, C. G. (2018). Una notable convergencia semántica: infección y miasma. Revista chilena de infectología, 35(1), 75-77.
[3] URL (17-02-20): https://www.mundoprehistorico.com/portfolio/hominidos/
[4] Roa, Ignacio, Smok S, Carolina, & Prieto G, Ruth. (2012). Placenta: Anatomía e Histología Comparada. International Journal of Morphology, 30(4), 1490-1496. https://dx.doi.org/10.4067/S0717-95022012000400036
[5] Harris, J. R. (1998). Placental endogenous retrovirus (ERV): structural, functional, and evolutionary significance. Bioessays, 20(4), 307-316.
[6] Chuong, E. B., Rumi, M. K., Soares, M. J., & Baker, J. C. (2013). Endogenous retroviruses function as species-specific enhancer elements in the placenta. Nature genetics, 45(3), 325.
[7] URL (19-02-2020): https://www.gov.uk/government/publications/health-protection-report-volume-12-2018/hpr-volume-12-issue-33-news-14-september#imported-cases-of-monkeypox-diagnosed-in-england
[8] URL (18-02-2020): https://ncdc.gov.ng/news/152/re%3A-monkeypox-cases-in-the-united-kingdom
[9] URL (18-02-2020): https://promedmail.org/promed-post/?id=20200218.7001717
[10] Chen, W., Yan, M., Yang, L., Ding, B., He, B., Wang, Y. & Huang, S. (2005). SARS-associated coronavirus transmitted from human to pig. Emerging infectious diseases, 11(3), 446.
[11] URL (19-02-2020): https://www.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6
[12] URL (19-02-2020): http://weekly.chinacdc.cn/en/article/id/e53946e2-c6c4-41e9-9a9b-fea8db1a8f51
[13] URL (19-02-2020): http://outbreaknewstoday.com/drc-reports-more-than-200-monkeypox-cases-in-january-82374/?fbclid=IwAR0p7Iap3wlRihY0n8xXI_BQSEVhkhSh8JciONoio_J8BFGBhIWYxFykYys
[14] Peng Zhou,et al. (2018). Fatal swine acute diarrhoea syndrome caused by an HKU2-related coronavirus of bat origin. Nature. Volume 556: 255–258. doi:10.1038/s41586-018-0010-9
[15] Bok, M., Alassia, M., Frank, F., Vega, C. G., Wigdorovitz, A., & Parreño, V. (2018). Passive immunity to control Bovine coronavirus diarrhea in a dairy herd in Argentina. Revista argentina de microbiología. 50 (1 ) : 23-30.
[16] URL (18-02-2020): https://www.lavanguardia.com/vida/20200205/473298566430/china-confirma-positivo-coronavirus-recien-nacidos.html
[17] URL (18-02-2020): https://www.livescience.com/coronavirus-spread-mother-child-pregnancy.html
[18] Zhou, P., Yang, X., Wang, X. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature (2020). https://doi.org/10.1038/s41586-020-2012-7
[19] Wu, F., Zhao, S., Yu, B. et al. A new coronavirus associated with human respiratory disease in China. Nature (2020). https://doi.org/10.1038/s41586-020-2008-3
[20] URL (19-02-2020): https://www.healtheuropa.eu/increasing-hand-hygiene-at-airports-will-reduce-the-spread-of-coronavirus/97682/
[21] URL (18-02-2020): http://outbreaknewstoday.com/study-shows-increased-hand-hygiene-at-top-10-airports-can-reduce-spread-of-coronavirus-by-37-percent-91091/
[22] URL (18-02-2020): https://www.3tres3.com/articulos/coronavirus-en-porcino-actualizacion_44383/
[23] URL (18-02-2020): https://www.consalud.es/lupa-sanitaria/amplian-24-periodo-incubacion-coronavirus_74130_102.html
[24] URL (18-02-2020): https://www.ft.com/content/60e0ea28-043c-36e7-a1b9-a90359655dbb
[25] URL (18-02-2020): https://actualidad.rt.com/actualidad/341278-coronavirus-infectar-distancia-dos-metros-ojos